안녕하세요, 저번 포스팅 <휘발유와 경유 알고 쓰시나요?-연료유 규격 및 시험법(1)>에서 말씀 드렸던대로 이번 포스팅에서는 휘발유와 경유의 주 성분이라 할 수 있는 탄화수소계 화합물에 관련된 규격 및 시험법에 대해서 다루어 보도록 하겠습니다.
탄화수소란(Hydrocarbon)말 그대로 탄소와 수소로 이루어진 화합물들입니다. 아마 ‘유기물’ 또는 ‘유기화학’이라는 말을 들어보신 적이 있을 텐데요, 여기서 말하는 ‘유기’물들이 바로 탄화수소계 화합물입니다. 여기서 ‘유기(有機)’라는 말은 ‘생명을 가지며 생활 기능이나 생활력을 갖추고 있음’ 을 뜻하는 명사입니다.
이전에는 유기물들은 생명체의 활동을 통해서만 합성되는 것으로 여겨졌기 때문에 이런 이름이 붙여졌습니다. 유기화합물을 영어로 Organic Compound 라고 하는데 여기서 이 Organic이라는 단어자체가 생명체, 유기체를 의미하는 영단어 Organism, 인체의 장기기관을 의미하는 Organ 등과 어원이 같습니다. 이후에 무기물로도 유기물을 합성할 수 있다는 사실이 밝혀지면서(1828년 독일의 F.뵐러가 무기물인 시안산암모늄으로부터 유기물인 요소를 합성한 것이 그 시초입니다) ‘유기물 = 생명체에서만 만들어지는 화합물’이라는 등식은 깨어졌지만, 유기화학/무기화학의 분류는 그대로 사용하고 있습니다.
다시 본론으로 돌아가겠습니다.
탄화수소계 화합물이라고 해서 탄소와 수소만 포함하는 것은 아닙니다. 두 가지 원소 이외에 추가적으로 다른 원소(질소, 황, 인 등)이 결합할 수도 있으나, 연료유의 관점에서 보면 해당 화합물들은 엔진 내에서 연소되었을 때 유독한 배기가스를 생성하기 때문에 그 함량이 법으로 엄격히 규제되어 있습니다. (저번 포스팅에 한국에서는 휘발유, 경유 모두 황 함량이 10ppm = 1/100,000 수준으로 제한된다고 했던 말, 기억하고 계시죠?)
단, 산소의 경우 연료의 완전연소를 도와주고 휘발유의 경우 옥탄가를 올려주는 효과가 있기 때문에 2.3%(중량기준)까지 허용하고 있습니다. 경유의 경우는 바이오디젤의 주 성분인 FAME(Fatty Acid Methyl Ester)가 산소를 포함하고 있는데 한국에서는 경유에 바이오디젤을 2%(부피기준) 혼합하여 판매하고 있습니다.
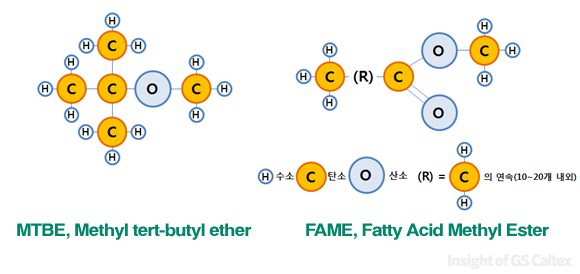
지금까지 요약한 내용을 정리하자면, 휘발유와 경유에 있어 기본적인 물성 규제는 곧 연료의 대부분을 차지하는 ‘탄화수소계 화합물’에 대한 규제라고 할 수 있습니다. 그리고 이 탄화수소계 화합물은 소량의 산소를 제외하곤 말 그대로 ‘탄소’와 ‘수소’로만 이루어져 있다고 볼 수 있습니다. 그럼 저번시간에 보여드린 휘발유, 경우 물성 규격 중 탄화수소 관련 부분만 다시 아래 표에 옮겨 보도록 하겠습니다.
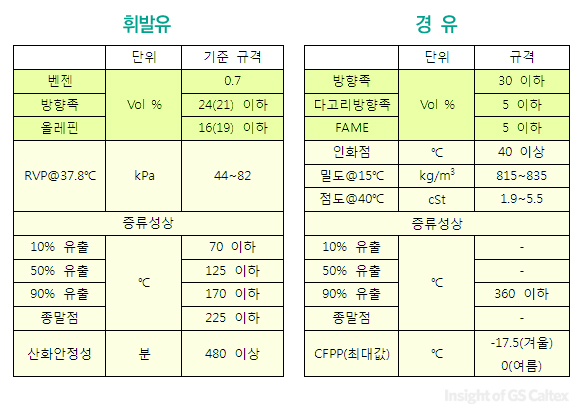
위의 규격들은 크게 다시 두 부분으로 나눌 수 있습니다. 휘발유와 경유를 이루는 각각의 탄화수소 성분에 대한 규제(노란색)과 모든 탄화수소들이 뭉쳐져서 나타내는 물성에 대한 규제(분홍색)이 바로 그것입니다.
이번 포스팅에서는 거시적으로 나타나는 물성규제에 대해 먼저 설명 드리도록 하겠습니다. 물성규격은 앞서 말씀 드린 바와 같이 연료유를 이루고 있는 개별 성분이 아니라, 이 성분들이 모두 모여서 나타내는 특징에 관한 규격이라고 생각하시면 되겠습니다.
‘밀도(물질의 단위부피당 무게)’라는 말은 많이들 들어보셨을 텐데요, 바로 이 밀도가 대표적인 물성이라고 할 수 있습니다.
쉽게 설명 드리기 위해서 조금 비약을 하자면, ‘물성규격 = 연료유 내 탄화수소가 평균적으로 가지고 있는 탄소의 개수에 대한 제한’이라고 할 수 있습니다(비약이라는 말을 쓴 이유는, 탄소 수가 같다고 하더라도 어떤 형태로 연결되어 있느냐에 따라 물성이 달라질 수 있기 때문입니다).
탄화수소는 탄소와 수소로 이루어져 있지만, 탄소가 수소에 비해 12배 가량 무겁고, 수소는 다른 원자들과 결합하는데 한계가 있으므로(‘화학결합 = 서로 원자간에 손을 맞잡는 것’이라고 생각하면 탄소는 손이 4개인데 수소는 손이 하나밖에 없다고 생각하시면 됩니다) 탄화수소의 분자무게 = 탄소 분자의 개수 라는 등식이 성립하게 됩니다. 아래의 표를 보시죠
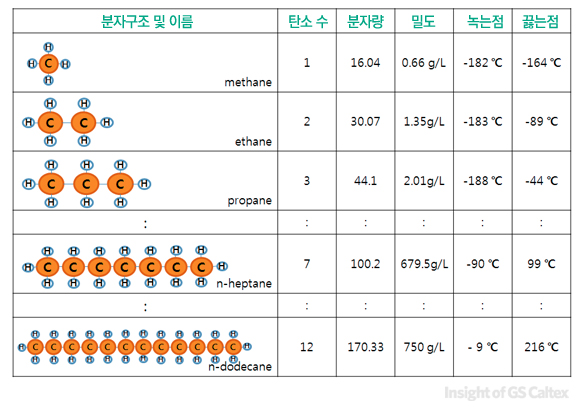
위의 표에서 보시는 것처럼 ‘탄소의 수가 많아진다 = 분자량이 커진다 = 밀도가 커진다 = 녹는점이 높아진다 = 끓는점이 높아진다’ 라는 등식이 성립함을 볼 수 있습니다. 따라서, 연료유의 물성은 곧 연료유 내에 존재하는 탄화수소의 평균 탄소 수에 의존한다고 할 수 있습니다.

그럼, 과연 이런 물성들은 높아야 좋은 것일까 아니면 낮아야 좋은 것일까?라는 의문이 생기는데요. 정답은 적당한 것이 좋다! 입니다.
예를 들어 밀도가 너무 높으면(= 분자들의 평균 탄소 수가 높아지면) 끓는점이 높아지기 때문에 엔진의 연소실 내부에서 기화가 잘 일어나지 않아 시동이 잘 걸리지 않거나, 연소 반응이 원활히 일어나지 못할 수 있으며, 지나치게 점도가 높아져서(액체가 잘 흐르지 않게 되는 것. 예를 들어 물엿은 물에 비해서 점도가 높다고 표현 할 수 있습니다) 연료 공급계통에 문제를 일으킬 수 있습니다.
반대로 밀도가 너무 낮아지면 점도가 너무 낮아져서 차량의 연료공급계통에 윤활이 잘 되지 않고, 연비도 나빠지게 됩니다.(연료유는 질량이 아니라 부피로 매매하기 때문입니다. 주유소에서 휘발유 30L만 넣어주세요~ 라고 하지 휘발유 30kg 만 주세요~ 라고 하지는 않지요) 때문에 적정값을 유지하는 것이 중요합니다. 위의 표에서 규격에서 상한선과 하한선이 모두 존재하는 규격(RVP, 밀도, 점도 등)들은 너무 낮아서도, 높아서도 안 되는 물성들입니다.
때문에 이러한 규격들이 연료유 내 탄소 분자의 개수를 제한하는 규격으로 작용하게 되지요. 평균적으로 휘발유는 탄소 수 4에서 9, 경유의 경우에는 12에서 20후반 사이의 탄소 수를 가지는 분자들로 이루어져 있다고 생각하시면 됩니다.
밀도, 점도는 들어본 것 같은데 RVP라는 말은 생소하시죠? RVP는 Reid Vapor Pressure의 약자로써, 가솔린의 휘발성을 측정하는 단위입니다. Vapor Pressure라는 말에서 알 수 있듯 증기압의 일종이죠. 증기압이란, 말 그대로 액체(또는 고체)에서 증발하려는 압력입니다.
자세한 설명을 하려면 복잡하니 ‘증기압이 높을수록 증발하려는 성질이 강하다’라는 정도만 기억하시면 될 것 같습니다. RVP는 ASTM(American Society of Testing Material)이라는 단체에서 지정한 규격(ASTM-D-323)을 따라 측정하여 구할 수 있는 증기압입니다. 증기압은 탄소 수에 반비례 하는데요, 즉 탄소 수가 작은 분자들이 많을수록 증기압은 높아집니다. 증기압이 너무 낮으면 차량의 시동성에 문제가 생길 수 있습니다.
그렇다고 너무 높으면 증발이 잘 일어나서 보관도 어렵고, 사람의 건강에도 안 좋은 영향을 주게 되지요.
각 휘발유 규격의 제일 밑에 나와있는 산화안정성은 말 그대로 공기 중에 노출 되었을 때 공기중의 산소와 얼마나 잘 결합하느냐(연료유는 기본적으로 엔진 내부에서 연소가 되어야 하는데 먼저 산소와 결합하면, 즉 산화반응이 일어나면 안되겠죠?)를 측정하는 규격이고, 경유의 제일 밑에 있는 CFPP(Cold Filter Plugging Point)는 겨울철 경유의 시동성을 평가하는 항목입니다.
탄소 수가 높으면 산화안정성이 좋아서 경유에는 산화안정성 규격이 빠져있고, 휘발유처럼 탄소 수가 낮으면 겨울철에도 얼지 않기 때문에 휘발유에는 CFPP 규격이 없습니다. 겨울철 갑자기 찾아온 한파로 연료가 얼어서 시동이 걸리지 않아 많은 사람들이 고생한다는 뉴스를 보신적 있으시죠? 그 뉴스와 관련된 것이 바로 경유의 CFPP항목입니다. 이 CFPP에 대해서는 다음 기회에 따로 포스팅 하도록 하겠습니다.
지금까지 설명한 모든 것들을 다 종합적으로 볼 수 있는 것이 바로 ‘증류성상’이라는 항목입니다. 영어로는 Distillation Property라고 하지요.
아마 밀도나 점도 같은 말보다는 다소 생소하실 텐데요, 간단하게 끓는점(액체에서 기체가 되는 온도)과 관련된 규격이라고 생각하시면 됩니다. 어렸을 때 초등학교 자연 시간에 ‘분별증류’ 실험 해 보신 적 있으시죠? 물과 혼합된 에탄올은 서로 잘 섞이지만 끓는점이 다르기 때문에 분별증류를 통해 분리해 낼 수 있습니다.
에탄올의 끓는점이 78℃이고 물의 끓는점이 100℃이니까, 물과 에탄올의 혼합물을 그 사이의 온도로 가열하면 에탄올만 끓게 되겠죠? 그리고 그 증기를 모아 다시 액화시키면 에탄올과 물을 분리해 낼 수 있지요! 이것이 증류의 기본 원리 입니다.
휘발유와 경유는 각각 끓는 점이 다른 수 많은 탄화수소 화합물들이 섞여 있는 액체이기 때문에, 당연히 온도에 따라 끓는(증류되는) 물질도 다르게 됩니다. 탄소 수가 많은 물질들일수록 끓는 점도 높기 때문에 온도에 따라 얼마나 많은 탄화수소들이 증류되는지(액체에서 기체가 되는지)를 측정하면 연료유에 무거운 탄화 수소가 얼마나 포함되어 있는지, 가벼운 탄화 수소는 얼마나 많이 포함되어 있는지 알 수 있습니다.
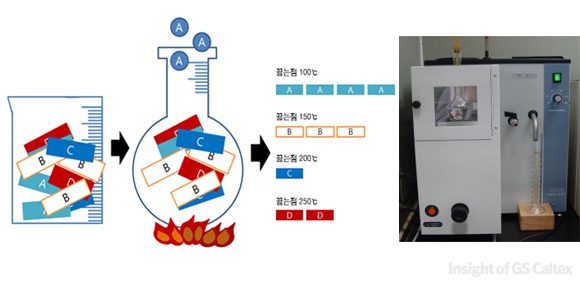
휘발유와 경유를 증류하는 목적은 정확히 어떤 물질이 들어있냐를 알아내는 것이라기 보다는 가벼운 물질은 얼마나, 무거운 물질은 얼마나 들어있는가 하는 것을 알아내기 위한 만큼, 혼합물을 분류할 때처럼 특정한 물질의 끓는 점을 목표로 하여 증류하지는 않고, 온도를 올려가며 해당 온도에서 얼마나 많은 연료유가 증류되는가를 측정합니다.
예를 들어 위의 표에서 10% 유출 온도가 70℃이하 라는 뜻은, 100mL의 연료유를 온도를 올려가며 끓였을 때, 10mL가 회수(끓어서 기체가 된 유증기를 포집한 후 다시 액화시켜 그 부피를 측정합니다)되는 온도가 70℃ 이하여야 한다는 뜻입니다.
증류실험법은 시험에 사용하는 연료의 양이나, 끓이는 속도, 회수하는 방법 등에 따라 실험결과가 다르게 나올 수 있는데, 우리나라에서는 세계적으로 가장 많이 사용하는 ASTM-D86 방식을 채택하고 있습니다. 실제 D-86 시험결과는 처음 끓어 나오는 점부터 10%~90%까지를 각 10% 단위로 측정하고 95%와 최종적으로 끓는 점, 그리고 유증기를 액화시켜서 회수한 양까지 측정하도록 되어 있지만 규격에는 모든 값들 중 대표성을 띈다고 할 수 있는 10%, 50%, 90%, 종말점 만을 표시합니다.
일반적으로 10% 유출 온도는 시동성, 50% 유출 온도는 차량의 가속성 및 매연과 같은 배출가스, 90%는 차량의 연비를 대표하는 값이라고 볼 수 있으며, 종말점은 말 그대로 연료유 내의 분자 중 가장 무거운 물질을 나타내는 수치라 할 수 있습니다.
이처럼 연료유의 물성 규격은 연료유 내부의 평균 탄소 개수와 연관이 있기 때문에 서로 연관을 가지고 있는 경우가 많습니다. 때문에 각 규격 항목들은 서로가 서로를 보완해 주는 존재라고 할 수 있습니다.
예를 들어 휘발유의 경우 경유와 달리 별도의 밀도 규격이 없다고 해도 RVP 규격과 증류성상 관련 규격이 존재하기 때문에 위 규격을 맞추려면 휘발유의 밀도는 필연적으로 한정된 범위로 좁혀지게 됩니다. 반대로 경유의 경우는 증류성상 관련 규격은 90% 유출온도 밖에 없으나 인화점, 밀도, 점도 및 CFPP 규격이 있으므로 마음대로 증류성상을 설정할 수 없습니다.
이번 포스팅은 이것으로 마치겠습니다. 긴 글 읽어주셔서 감사드립니다.
다음에는 오늘 다루지 못한, 탄화수소의 각 성분에 관한 규제에 대한 포스팅으로 찾아 뵙도록 하겠습니다.



