안녕하세요. 이번에는 ‘휘발유와 경유 알고 쓰시나요? – 연료유 규격 및 시험법’ 그 마지막 순서로 탄화수소의 각 성분에 관한 규제에 대해 포스팅 해 보도록 하겠습니다.
탄화수소란 말 그대로 ‘탄소’와 ‘수소’를 주 성분으로 하는 화합물입니다. 탄화수소계 화합물은 지난 포스팅 휘발유와 경유 알고쓰시나요?-연료유 규격 및 시험법(2)에서 말씀드린 바와 같이, 탄소의 수에 따라 일정한 경향성을 가지고 물성이 변화하게 됩니다. 그런데 탄소 수가 같더라도 탄소와 수소가 어떻게 결합하느냐에 따라 물성이 크게 달라지기도 합니다.
때문에 탄화수소의 종류에 따라서도 규격이 존재하지요! 관련 규격 중에서 오늘 설명드릴 부분에 관계된 규격만 모아서 아래의 표에 나타내었습니다. 마지막이라서 그런지 표도 단촐 하네요.
이해를 돕기 위해, 설명에 앞서 간단한 화학 상식 하나 짚고 넘어 가도록 하겠습니다(기본적인 내용이므로 화학 결합에 대한 기본적인 상식이 있으신 분들은 건너 뛰셔도 상관 없습니다).
탄화수소계 화합물들은 탄소와 수소의 공유결합(2개의 원자가 서로 전자를 방출하여 전자쌍을 형성하고 이를 공유하여 형성되는 결합)으로 이루어 집니다. 쉽게 생각하면, ‘결합 = 탄소와 수소가 서로 손을 맞잡는 것’이라고 생각하시면 됩니다.
그런데 탄소는 손이 4개, 수소는 손이 1개만 있습니다. 때문에 수소는 한번에 두 원자랑 결합을 할 수가 없습니다. 지금부터 설명드릴 다양한 탄화수소계 화합물들은 모두 이 규칙을 만족합니다.
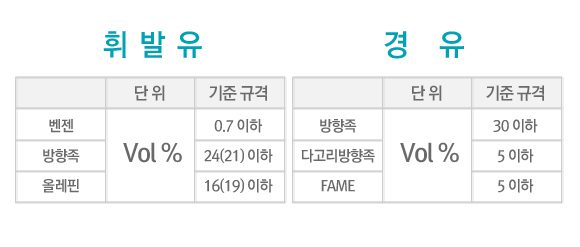
앞서 설명한 규칙 하에서 떠올릴 수 있는 가장 쉬운 탄화수소 구조는, 아래의 그림처럼 탄소가 일렬(엄밀히 말하면 전자쌍간의 반발로 인해 일직선으로 늘어서진 않지만, 그것까지 설명하려면 포스팅이 너무 길어질 것 같아 생략합니다)로 늘어서고 수소가 각 사슬의 외곽에 위치한 구조입니다.
위의 화합물들은 탄소 수에 따라서 물성이 달라지지만, 탄소 원자수가 n개라면 수소원자는 2n+2개를 가진다는 점은 동일합니다. 위와 화합물들을 파라핀(Paraffin)이라고 하는데, 거의 물에 녹지 않으며 에테르나, 벤젠, 에스테르 등에 녹는 특징을 가지고 있습니다. 유기화학에서는 알칸(Alkane)계 화합물이라고 하며, 추가적으로 다른 원자와 결합할 수 없기 때문에 ‘포화탄화수소(saturated hydrocarbon)’이라고 부르기도 합니다.
하지만 같은 탄소수를 가진 파라핀이라고 해도 화합물들은 탄소의 배열방식에 따라 또 다시 여러 종류로 나뉠 수 있습니다. 이렇게 분자를 구성하는 원소의 조합은 동일하지만 배열방식이 다른 물질들을 동소체(isomer)라고 합니다. 예를 들어 탄소 5개, 수소 12개로 이루어진 펜탄(Pentane)은 아래 그림과 같은 세 가지의 형태로 존재할 수 있습니다.
이러한 동소체들은 원자의 구성은 같으나 밀도나 끓는점, 녹는점 같은 물성이 다르기 때문에 엄연히 다른 물질입니다. 때문에 서로 다른 이름으로 불러야 하는데 문제는 탄소수가 증가함에 따라 동소체의 수가 큰 폭으로 증가한다는데 있습니다.
파라핀계열 화합물의 경우, 탄소수 3개까지는 동소체가 존재하지 않고, 4개인 부탄의 경우 동소체가 1개, 5개인 펜탄의 경우 위의 그림처럼 3개의 동소체를 가지고 있지만 탄소수가 12개가 되면 355개, 탄소수가 32개가 되면 27,711,253,769개의 동소체가 존재하게 됩니다.
이처럼 화합물의 개수가 많아지면 모든 화합물에 별도의 이름을 붙여 구분하는 것이 불가능에 가깝기 때문에, IUPAC (International Union of Pure and Applied Chemistry)라는 단체에서 파라핀을 포함한 모든 유기화합물들을 명명하는 일반적인 규칙을 제정하였습니다(참조).
해당 규칙에 따르면 위의 isopentane은 2-methylbutane, neopetane은 2,2-dimethylpropane이 됩니다. IUPAC의 명명법은 이름만 가지고 분자 구조를 유추할 수 있다는 장점이 있지만, 다소 복잡하다는 단점이 있어 일반적으로 잘 알려진 화합물의 경우에는 IUPAC 명명법을 사용하지 않습니다.
예를 들어 옥탄가 측정의 기준이 되는 2,2,4-Trimethlypentane의 경우, 이소옥탄(iso-Octane)이라는 이름을 더 많이 사용합니다. 휘발유와 경유는 혼합물이므로 위처럼 파라핀계열 혼합물들을 하나하나 구분해서 부르는 경우는 많지 않고, 일직선 사슬구조로 된 파라핀들을 n(노르말)-paraffin, 하나 이상의 가지를 가지는 파라핀들을 iso(이소)-paraffin 혹은 branched-paraffin이라고 구분하여 부릅니다.
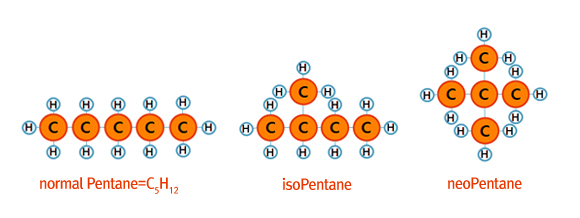
앞서 파라핀계열 화합물은 추가적으로 다른 원자와 결합할 수 없어 ‘포화탄화수소’라고도 부른다고 말씀 드렸는데요, 위의 원자들과 원자의 개수는 다르지만 역시 해당 조건을 만족하는 화학 결합이 존재합니다. 바로 탄소들이 고리 구조를 이루는 방식인데요, 이러한 조합은 시클로(사이클로) 파라핀(cyclo-paraffin)= 시클로 알칸이라 부릅니다.
탄소 n개에 대하여 2n+2 개의 수소를 가지는 파라핀과 달리 이들은 2n+1-g(g=화합물 내 고리 구조의 개수)의 수소를 가집니다.
이런 시클로파라핀은 나프텐(naphtene)이라고도 합니다(좀약의 주 성분인 나프탈렌(naphthalene)과 혼동하시면 안됩니다).
나프텐의 함량은 원유를 구분하는데 있어 중요한 지표가 되기도 하는데요, n-parrafin함량이 많은 원유를 paraffinic oil, 나프텐 함량이 높은 원유(일반적으로 paraffin함량이 55~60% 이하)를 naphtenic oil이라고 합니다. 파라핀계열 화합물들은 반응성이 크지 않고 연소되었을 때 오염물질을 배출하지 않아 별도로 그 함량을 규제하지는 않습니다.
그러나 휘발유의 경우 동일 탄소 수를 기준으로 하였을 때 n-paraffin의 경우 isoparaffin보다 옥탄가가 낮고, 경유의 경우 n-paraffin은 겨울철에 시동꺼짐의 원인이 될 수 있기 때문에 정유공정 중에는 n-paraffin을 isoparaffin으로 바꿔주는 단계가 있습니다.
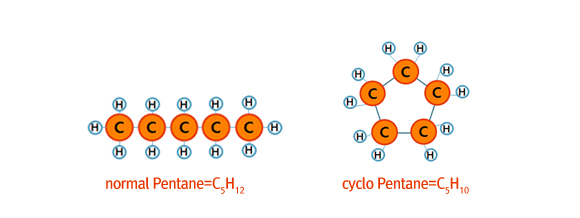
휘발유의 규제항목에 포함되어 있는 올레핀(Olefin)의 경우 2중 결합을 1개 가지고 있는 탄화수소 화합물을 의미합니다. 2중결합이란 아래 그림처럼 탄소원자가 손을 하나가 아니고 두 개씩 맞잡은 것이라고 생각하시면 됩니다.
파라핀의 경우 수소와 맞잡았을 손을 인접한 탄소와 잡고 있기 때문에 탄소 수 n개에 2n+2개의 수소를 가지는 파라핀과 달리 올레핀은 탄소 수 n개에 2n개의 수소를 가집니다.
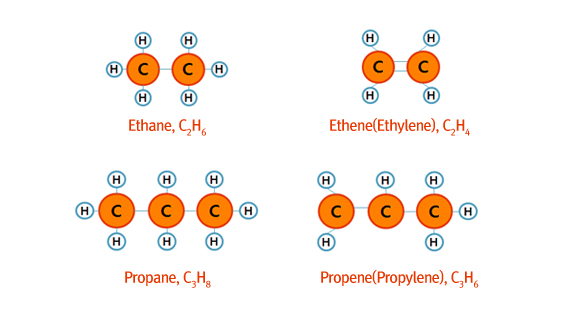
파라핀을 알칸이라고도 하는 것처럼 올레핀은 알켄(alkene)계 화합물이라고도 합니다. 알칸계 화합물들이 프로판(Propane), 부탄(Butane)과 같이 –ane으로 끝나는 반면 알켄계 화합물들은 프로펜(Propene 혹은 프로필렌=propylene), 부텐(Butene, 혹은 부틸렌=butylene)과 같이 -ene로 끝나는 이름을 가지고 있습니다.
올레핀 계열 화합물들은 탄소간의 2중결합이 끊어지며 다른 원소들과 추가적인 결합을 할 수 있기 때문에 파라핀 대비 반응성이 좋습니다. 때문에 석유화합 공업에서 기초원료로 사용되는 물질이기도 합니다. 그러나 높은 반응성으로 인하여 대기 중에 노출 되었을 때 오존형성물질의 생성을 증가시키며, 파라핀 보다 산화되어 변질되기 쉽기 때문에 그 함량이 제한되어 있습니다.
휘발유와 경유 모두 ‘방향족’이라는 규제 항목이 포함되어 있습니다. 방향족(aromatic compound)는 분자 속에 벤젠(Benzene)고리를 가진 유기화합물을 의미합니다. 벤젠 분자는 6개의 탄소원자가 교대로 단일 결합과 이중결합으로 연결된 고리를 가지고 있습니다.
이 벤젠 구조는 독일의 화학자 케쿨레가 처음 밝혀 냈습니다. 당시의 구조론으로는 벤젠의 구조를 설명할 수 없었는데, 케쿨레가 꿈 속에서 서로 꼬리를 물고서 고리를 이루고 있는 뱀을 보고 벤젠 구조를 떠올렸다는 일화는 유명하지요.
탄소들간의 이중결합과 단일결합이 교대로 이루어져 있으나, 그 위치가 고정되어 있는 것은 아니고 이중결합의 위치가 지속적으로 바뀌는 공명구조를 지니기 때문에(아래 그림의 왼쪽과 가운데) 탄소들간의 거리는 동일합니다. 때문에 육각형 안에 원 하나를 그려 벤젠 고리를 나타내기도 합니다.
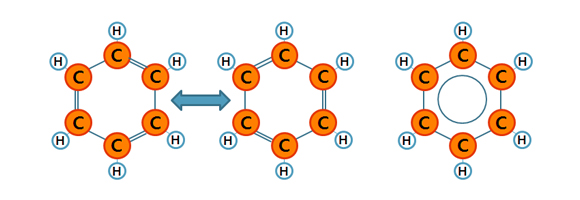
방향족 중에 가장 대표적인 화합물이라면 벤젠과 벤젠의 탄소 중 하나에 메틸(CH3-)기 하나가 붙은 톨루엔(Toluene), 탄소 두 개에 메틸기가 결합한 자일렌(Xylene, 크실렌이라고 읽기도 합니다.)이 있습니다. 해당 물질들 휘발유에 혼합되어 사용될 수도 있으나, 용매로써 활용되기도 하고 합성섬유, 플라스틱, 고무등의 원료로도 활용됩니다. 석유화학공업 중에 BTX 공업이라는 것이 있는데 이 BTX가 바로 Benzene, Toluene, Xylene의 머리글자를 합쳐 만든 용어입니다.
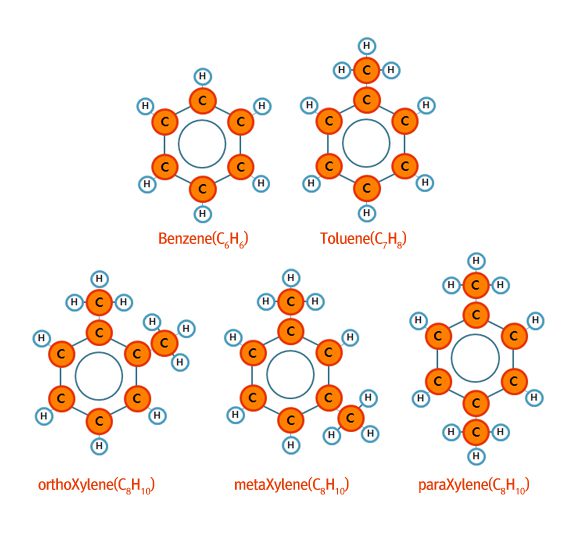
방향족 화합물들은 옥탄가가 높아 휘발유의 주 성분으로써 활용될 수 있으나 독성이 강하고 연소 시 파라핀계열보다 오염물질을 많이 발생시키므로 그 함량이 제한되어 있습니다. 방향족은 대부분의 화합물들이 특유의 냄새가 있어서 방향(芳香, Aromatics)족 이라고 불리는데, 요즘 유행하는 아로마테라피(Aromatheraphy)와 어원은 같을지라도 인체에 좋지 않은 영향을 주기 때문에 오해하시면 안됩니다!
한국의 경우 휘발유 내의 방향족 함량은 최대 24%, 경유의 경우 30%로 제한되어 있습니다. 90년대 초, 중반 휘발유내의 방향족 함량 규제가 55% 수준이었다는 것을 감안하면 굉장히 그 규격이 강화된 것을 알 수 있습니다.
방향족 중에서도 벤젠의 경우 대표적인 발암물질이기 때문에 그 함량 규제가 따로 지정되어 있습니다. 한국의 경우 휘발유 내의 벤젠 함량 규제는 0.7%로 세계 최고 수준의 규격을 유지하고 있습니다. 경유의 경우 끓는 점 차이로 인해서 벤젠이 포함되지 않기 때문에 별도의 규정이 없습니다.
대신 경유에는 다고리방향족(PAH, Polycyclic Aromatic Hydrocarbon)에 대한 규제가 있습니다. 다고리방향족은 말 그대로 복수의 벤젠링을 포함하고 있는 탄화수소를 의미하며, 역시 잠재적인 발암물질이므로 그 함량을 법으로 제한하고 있습니다. 하지만 분자량이 커서 끓는점이 높아 휘발유에는 포함되지 않기 때문에 휘발유 규제에는 포함되어 있지 않습니다.
마지막으로 한가지 더! 휘발유의 규제 항목을 보시면 방향족의 규제치가 24(21)%, 올레핀의 규제치가 16(19)%로 되어 있는 것을 보실 수 있는데요, 이는 방향족+올레핀의 함량이 40%를 넘을 수 없음을 의미합니다.
즉, 올레핀 함량이 16%이하라면 방향족은 최대 24%까지 포함될 수 있지만, 올레핀 함량이 19%라면 방향족 함량은 21%를 넘을 수 없다는 뜻입니다.
이상으로 ‘연료유 규격 및 시험법’에 대한 포스팅이 끝났습니다. 방대한 내용을 압축해서 다루다 보니 제대로 다루지 못한 부분도, 설명이 부족한 부분도 많았음에도 읽어주신 모든 분들께 감사 드립니다. 앞으로 좀 더 유익하고 재미있는 글을 쓸 수 있도록 노력하겠습니다. 그럼, 새로운 주제로 찾아올 다음 포스팅을 기대해 주세요!




